應用教學
應用教學
化學遺傳學與DREADD受體簡介
![]() APR 16 ,2021
APR 16 ,2021
總論
拜日益精進的研究所賜,科學家們已經可以利用後天修飾G蛋白偶連受體 (G-protein coupled receptors, GPCRs) 的方式來保留或者修改受體的功能與特性,例如受體跟特定活化劑的關係。受特定藥物活化的特殊受體 (DREADDs) 是一種人工改造過的GPCR,這種受體只會被特定的小分子藥物活化,因此我們可以利用此種特性,使DREADDs在動物內被表現,使用特定藥物來開啟/關閉受到DREADD調控的區域與神經迴路,進而觀察該神經傳導路徑對於動物行為或生理現象的作用機制或調控,此種實驗模式即被稱做化學遺傳學 (Chemogenetics)。 這篇文章我們將會來向您介紹DREADD以及其相關藥物的特性。
將DREADD使用在活體動物並進行實驗的技術已經非常成熟,目前也已經可以直接買到表現出DREADD的動物,其受體的調控也非常的簡單,只要讓動物攝取藥物即可,無需植入膠囊或使用侵入性的方式來讓藥物進到動物體內,同一隻動物也可以擁有不同的DREADD,進而達到階段性的活化,例如使用不同的DREADD來調控不同的腦區,或是先後調控兩個不同的器官。
DREADD 最早是來自某次使用酵母進行毒蕈受體測試所誕生的意外產物 ,目前市面上已經擁有下列不同種類的DREADD,依照活化路徑可分為以下四個大類: Gi、 Gq、 Gs 以及 β-arrestin 。
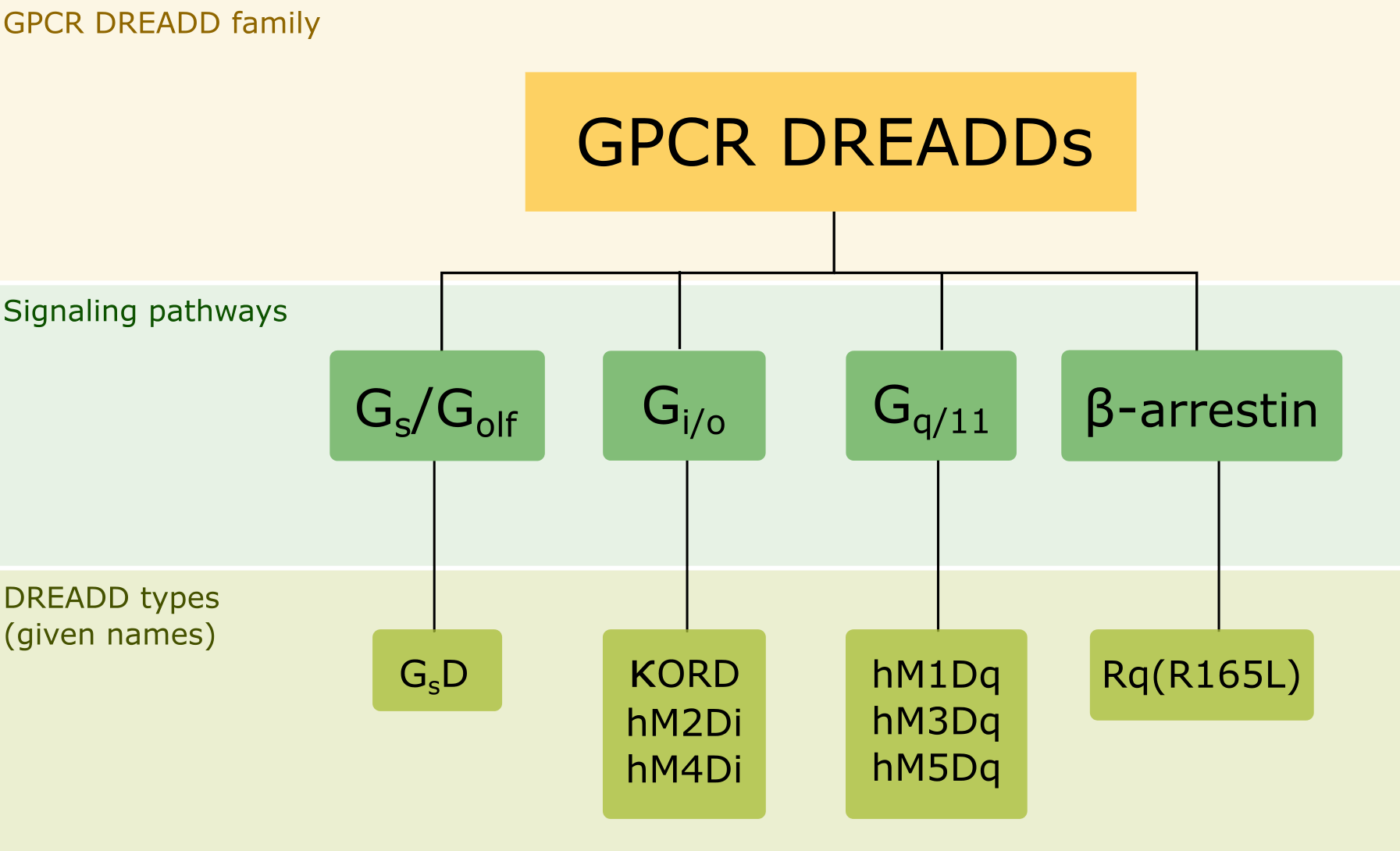
Figure 1. Categorization of DREADDs according to signal transduction mechanisms that they tether (Gi, Gq, Gs, or β-arrestin)
興奮型 Gq-DREADDs
最先被發現的DREADD族群之一,此類DREADD基於人類 M3 毒蕈受體 (hM3) (Figure 2) ,hM3 上只有2個突變點 (Y3.33C and A5.46G) 需要修改即可將此受體修改為可透過 CNO 藥物調控且對乙醯膽鹼 (ACh) 非常的不靈敏。這個DREADD後來被命名為 hM3Dq。 M1 與 M5 毒蕈受體 (同樣跟 Gq/11 蛋白為成對關係) 之後也同樣被用來開發出新的 DREADDs (分別為hM1Dq 與 hM5Dq) 。
hM3Dq DREADD 受器本身受到了 CNO 藥物的調控,並且與 Gq/11 成對並調控訊息傳遞,活化了 Gq 成對的 DREADD 將會造成細胞內的鈣離子濃度會顯著的上升 ,進而啟動第二訊息傳遞因子並造成與細胞功能增強有關的激脢被活化 (例如 蛋白激脢 C (PKC) 以及 Ca2+/calmodulin依賴性激脢 (CAMKs)。
Gq-DREADDs 常被用來做腦部海馬迴的相關研究 ,因為Gq訊號傳遞已被證實與海馬迴的記憶生成有關,此外,Gq就亦與日夜週期的調控有關,使用DREADD藥物調控Gq亦可進行睡眠與日夜週期的相關研究。
抑制型 Gi-DREADDs
最常被提及的為抑制型的 hM4Di,此類DREADD從毒蕈 M4 受器分化而來且與 Gi 蛋白成對,另一個人類毒蕈受器 M2 也被拿來人工突變並研製成DREADD hM2D。 在上述例子中 M4 與 M2 受器的Y3.33C 與 A5.46G 兩個點突變後皆產生了對 CNO 藥物的高敏感度,就如同Gq型DREADD一樣,科學家們可使用CNO來調控Gi型的DREADD們
另一種抑制型的 Gi-DREADD 是 Kappa鴉片型受器 (Κappa-opioid-receptor, KOR) DREADD (KORD) ,此種DREADD則是被另一種藥物 salvinorin B (SALB) 所調控。KORD是透過修改人類的 KOR ,將其 D138N 處點突變而成。 SALB 對KOR具有不錯的親和力,不過實驗時仍然得注意藥品的濃度,避免過濃進而影響到非KORD的受器。
Gi 成對 DREADD 目前已知有活化G蛋白內生型鉀離子通道 (G-protein inwardly rectifying potassium channels, GIRKs),進而造成膜電位過極化並抑制神經活性的作用。 此類DREADD目前最常被用來研究與認知抑制有關的飲食不正常行為(暴食、厭食等) ,亦可用來進行Gi訊息傳遞路徑相關的研究,例如紋狀體(Striatum)區域的神經可塑性。神經元內的Gi 成對的 DREADD被活化會造成該區域的突觸無法釋放神經傳導因子。
Gs與β-arrestin DREADDs
Gs 成對 DREADDs 也被開發出來了,這類型的受體 (又名 GsD) 為嵌合型受體,結合了火雞紅血球以及大鼠毒蕈受器而成。產生的 Gs DREADD 擁有絕佳的結構活性,可用於活體動物的 Gs 與 Golf 訊息傳遞路徑研究。
與 β-arrestin 成對的 DREADD亦已被研發,此類 DREADD 在非活體實驗中可以用來活化 β-arrestin 路徑,雖說如此,此DREADD需要高濃度的CNO才能被活化,這大大的降低了其實用價值。
Gs 成對受體透過活化腺苷酸環化脢 (adenylyl cyclase) 來調節訊息傳遞,脢活化後會增加第二訊息傳遞因子cyclic AMP (cAMP). cAMP 會接著活化蛋白質激脢A (protein kinase A) 進而增強細胞的運作。
Gs-DREADDs 通常被用來研究日夜週期及其相關的訊息傳遞路徑。
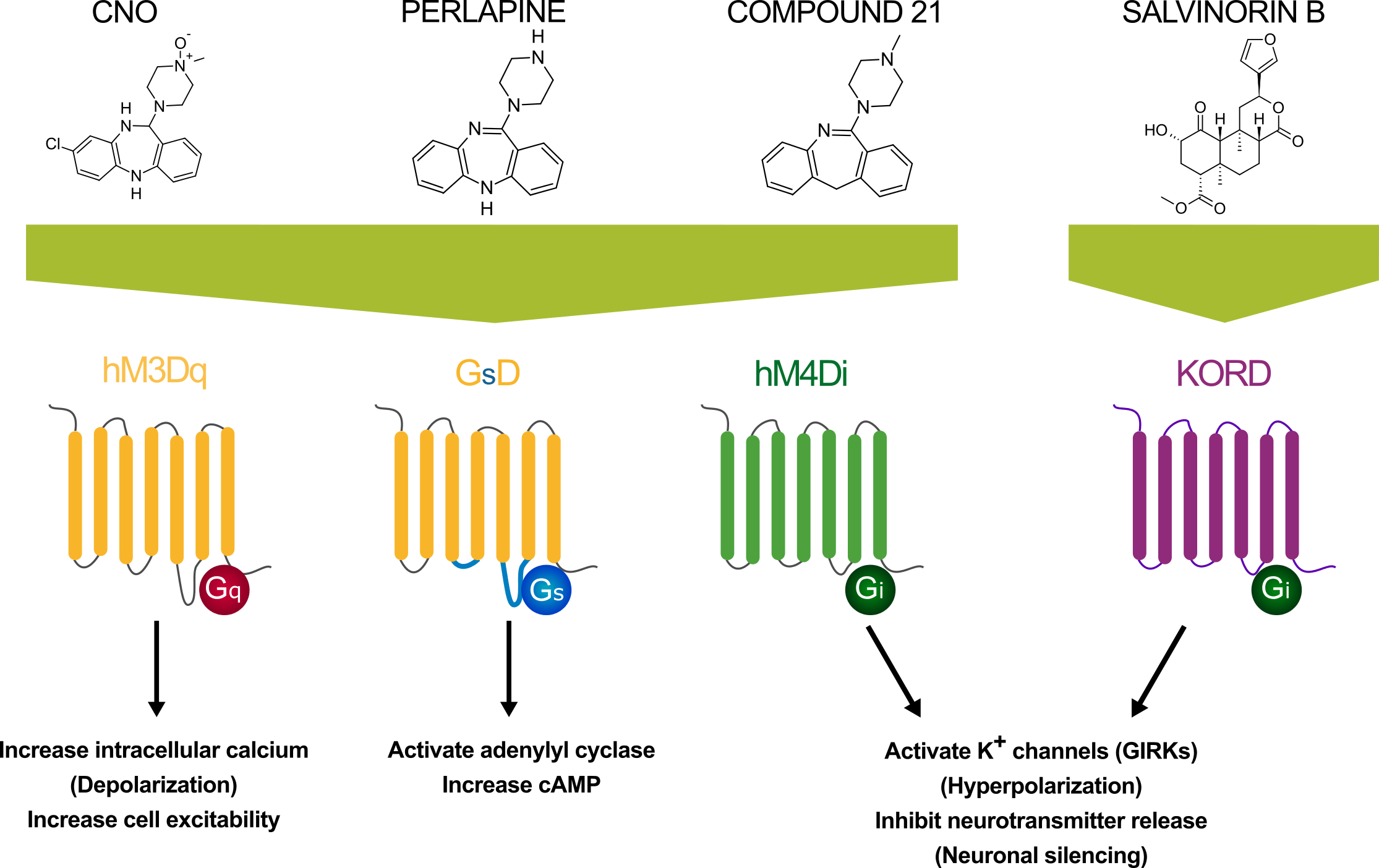
Figure 2. Designer compounds (CNO, perlapine, Compound 21, SALB) used to activate various DREADDS and their downstream pathways
所以說......要怎麼在活體動物中表現 DREADDs
若要在單一種類的細胞內表現DREADD,目前最常見的方法為使用腺病毒作為載體,將帶有DREADD編碼的蛋白質送入動物體內。我們可以直接將該病毒注射至基因改造過的小鼠內,經過原位重組後該小鼠就會表現出DREADD。
DREADD 相關藥物
CNO 是典型的 DREADD 啟動藥物,此藥品可用來啟動興奮性的 Gq 成對 DREADD,包含了 hM3Dq、hM1Dq、hM5Dq 以及抑制型的 hM4Di 與 hM2Di Gi 成對 DREADD。 CNO 亦可用來啟動 Gs 成對 DREADD (GsD) 與 β-arrestin DREADD rM3Darr (Rq(R165L).
CNO 投放可以用腹腔注射 (i.p.)、皮下注射、腦部顯微注射、摻入飲食飲水、使用 植入式給藥膠囊 甚至是眼藥給予。CNO亦有水溶性的版本, CNO dihydrochloride,對於活體給藥方式的彈性又更大得多。
不過,近期的研究指出 CNO 不太容易穿過腦血管屏障,且會裂解成 Clozapine 一種針對 hM3Dq 與 hM4Di DREADD 的啟動藥物,其性質與原本的CNO略為不同 (原本的CNO偏好啟動hM1Dq、hM3Dq與hM5Dq) ,因此在設計實驗時請務必將腦血管屏障這個點也考慮進去。
CNO過不去腦血管屏障且會裂解的這問題對許多人的實驗設計都造成了困擾,然而 DREADD 促進濟 21 (Compound 21) 的誕生給了科學家們另一種化學遺傳學藥物選擇,Compound 21 擁有高度的毒蕈受體選擇性,並且其易於穿透腦血管屏障,使用Compound 21可以更容易活化腦內的DREADD,Compound 21結構穩定,不像CNO會有裂解的問題,因此Compound 21逐漸取代CNO 成為了 DREADD 主流藥物。 水溶性的版本 亦已於市面上販售。
其他種類的DREADD (Gq-, Gi-, 以及 Gs ) 啟動藥物是結構與CNO相似的 Perlapine,這是一個在日本已經被應用在臨床治療失眠上的藥物。Perlapine 也是一個強效的毒蕈受體活化劑,它可以作用在興奮型的 hM3Dq, hM1Dq 以及抑制型的 hM4Di DREADD, 這個藥物已經有報告指出它不會像CNO一樣裂解成clozapine。 水溶性的版本 現在亦已商品化可供學者們購買。
Salvinorin B (SALB) 是一種 KOR 選擇性活化劑Salvinorin A (SALA)的未活化代謝產物,SALB是一種選擇性的KOR DREADD活化劑,對鴉片型受器的親和性極高,並且特別針對人類的鴉片受器,SALB也很容易進入並影響動物的中樞神經。
我們的優質供應商Hello Bio 同時也生產了新興的DREADD相關藥物,例如 J60 dihydrochloride 以及 J52 dihydrochloride - 這兩種藥物適用於活體動物,並且對 hM3Dq 以及 hM4Di DREADD有非常強的親和力 點我閱讀更多新興DREADD藥物的相關資訊
更多相關資訊
我們也有發表了一些關於DREADD的相關技術指南,歡迎點擊詳閱:
- Stability of Water-Soluble DREADD Ligands in Solution: A Technical Review
- Clozapine N-Oxide (freebase) - a technical review on stability, solubility and use in the lab
參考文獻
- Armbruster BN et al (2007) Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proc Natl Acad Sci U S A 104(12) 5163-8. Pubmed ID:17360345
- Conklin BR et al (2008) Engineering GPCR signaling pathways with RASSLs. Nat Methods 5(8) 673-8. Pubmed ID:18668035
- Agulhon C et al (2013) Modulation of the autonomic nervous system and behaviour by acute glial cell Gq protein-coupled receptor activation in vivo. J Physiol 591(22) 5599-609. Pubmed ID:24042499
- Garner AR et al (2012) Generation of a synthetic memory trace. Science 335(6075) 1513-6. Pubmed ID:22442487
- Brancaccio M et al (2013) A Gq-Ca2+ axis controls circuit-level encoding of circadian time in the suprachiasmatic nucleus. Neuron 78(4) 714-28. Pubmed ID:23623697
- Vardy E et al (2015) A New DREADD Facilitates the Multiplexed Chemogenetic Interrogation of Behavior. Neuron 86(4) 936-46. Pubmed ID:25937170
- Carter ME et al (2013) Genetic identification of a neural circuit that suppresses appetite. Nature 503(7474) 111-4. Pubmed ID:24121436
- Parnaudeau S et al (2013) Inhibition of mediodorsal thalamus disrupts thalamofrontal connectivity and cognition. Neuron 77(6) 1151-62. Pubmed ID:23522049
- Kozorovitskiy Y et al (2012) Recurrent network activity drives striatal synaptogenesis. Nature 485(7400) 646-50. Pubmed ID:22660328
- Stachniak TJ et al (2014) Chemogenetic synaptic silencing of neural circuits localizes a hypothalamus to midbrain pathway for feeding behavior. Neuron 82(4) 797-808. Pubmed ID:24768300
- Farrell MS et al (2013) A Gαs DREADD mouse for selective modulation of cAMP production in striatopallidal neurons. Neuropsychopharmacology 38(5) 854-62. Pubmed ID:23303063
- Nakajima K et al (2012) Design and functional characterization of a novel, arrestin-biased designer G protein-coupled receptor. Mol Pharmacol 82(4) 575-82. Pubmed ID:22821234
- Ferguson SM et al (2013) Direct-pathway striatal neurons regulate the retention of decision-making strategies. J Neurosci 33(28) 11668-76. Pubmed ID:23843534
- Chen X et al (2015) The first structure-activity relationship studies for designer receptors exclusively activated by designer drugs. ACS Chem Neurosci 6(3) 476-84. Pubmed ID:25587888
- Guettier JM et al (2009) A chemical-genetic approach to study G protein regulation of beta cell function in vivo. Proc Natl Acad Sci U S A 106(45) 19197-202. Pubmed ID:19858481
- Gomez et al (2017) Chemogenetics revealed: DREADD occupancy and activatoin via converted clozapine. Science 357(6350):503-507. Pubmed ID:28774929
- Thompson et al (2018) ACS Pharmacol.Transl.Sci. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. https://pubs.acs.org/doi/10.1021/acsptsci.8b00012

 Facebook
Facebook

 LINE
LINE